약리학/강의
[약리학] 임상약리학의 기초(2)
CDeo
2024. 8. 1. 23:02
KOCW 인제대학교 2021-2 이윤미교수님 약리학 강의를 듣고 정리 및 추가한 내용입니다.
약물의 종류
약물은 처방받아야 얻을 수 있는, 처방 약물, 처방받지 않아도 얻을 수 있는 일반 판매약품으로 나뉩니다.
- Prescription drugs (처방약물)
- Nonprescription drugs (비처방약물)
- Over-the-counter (OTC) drugs: 일반판매약
이러한 분류 기준 말고도 아래의 세분화된 분류 기준이 있습니다.
- Controlled substances (규제약물)
-
- 신체적, 정신적 의존성유발
- 진통제
- Schedules of controlled substances (단계별로 나누어둠)
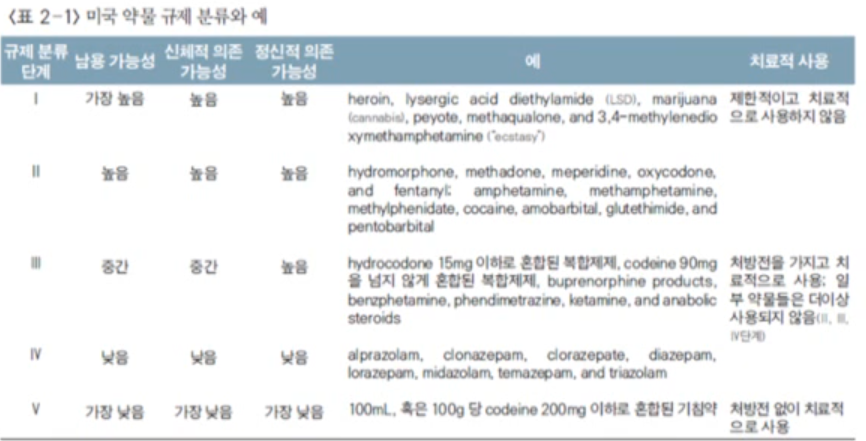
단계 1에 가까울 수록 가장 의존성이 높은 위험 약물로 치료 목적으로 사용하지 않습니다. 단계 2의 경우 암환자와 같은 중증 환자의 진통을 위한 약물입니다.

임신시 기형유발의 단계에 따라 나누어진 범주도 있습니다. 범주 A는 가장 안전한 약으로 임산부와 태아에게 모두 위험이 없는 약입니다. 범주 B는 동물실험에서는 괜찮지만, 임신한 여성을 대상으로의 안전성을 확실하지 않은 경우입니다. 알파벳이 높아질 수록 위험한 약물입니다. 범주 X의 경우 contraindication! 라 적혀있으니, 이는 무조건 기형아가 나올 수 있는 범주입니다.
- Herbal substances
- Orphan drugs (희귀의약품)
- Orphan disease: diseases that affect fewer than 200,000 individuals in the USA
- Street drugs
신약개발의 단계
신약개발은 7년~12년 정도가 걸리는 굉장히 긴 여정입니다. 각 단계는 아래와 같이 이루어집니다.
- Pre-FDA phase
- Drug design
- FDA phase
- IND (Investigational New Drug)
- Clinical trials: Phase I-III
- NDA (New Drug Application)
- Phase IV: Post marketing surveillance
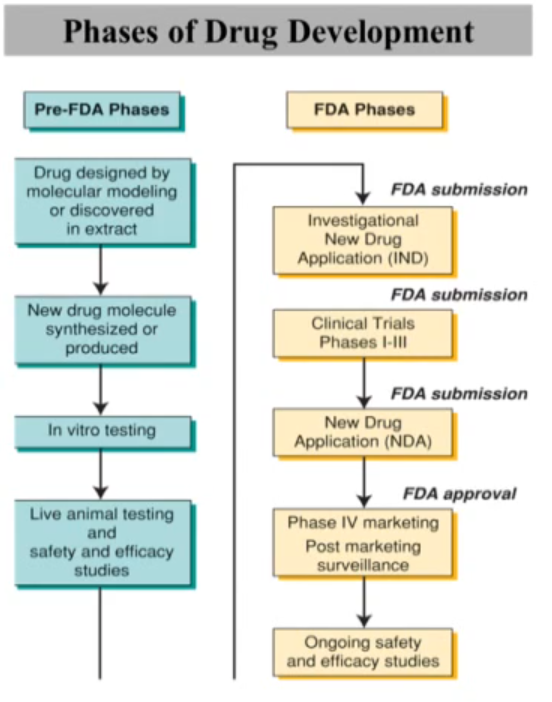
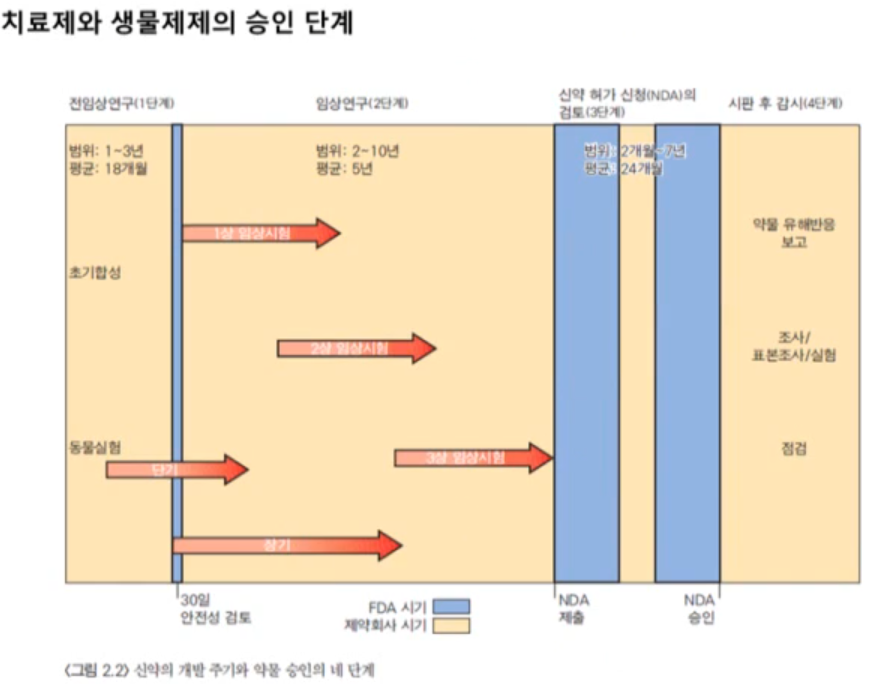
참고로 임상시험도 단계마다 약간씩 성격이 다릅니다.
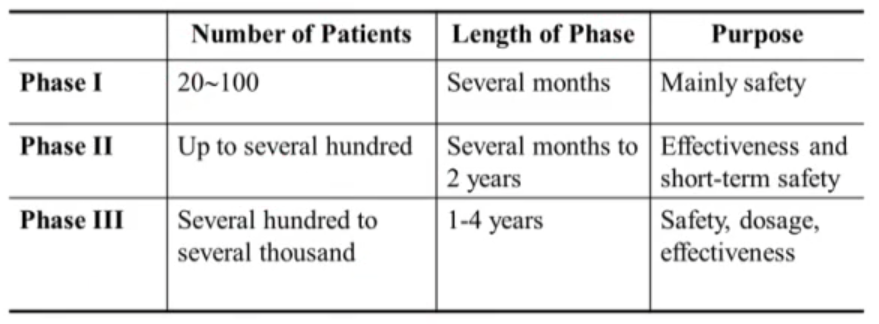
임상 1은 안정성을 평가합니다. 임상 2는 단기간의 안정성과 효능을, 마지막 임상 3은 안정성과 용량, 효과를 포괄적으로 다룹니다. 임상시험을 전부 통과한다면 NDA 서류를 제출하고, 임상 4시험으로 팔린 약물의 안정성을 감독합니다.